在平常学习和生活过程中,我们常会遇到各种PCR叫法,包括PCR、qPCR、RT-PCR、RT-qPCR、Real-Time PCR,很多人往往难以弄清楚这几种PCR有什么区别。下面简单的介绍一下这几种PCR之间的区别。
一、PCR是什么?
PCR是聚合酶链式反应(Polymerase Chain Reaction)的简称,是美国科学家Kary B. Mullis1985年发明的一种在体外快速扩增特定DNA片段的技术,它能以极少量的DNA为模板,在几小时内复制出上百万份的DNA拷贝。Mullis 因此获得了1993年诺贝尔化学奖。PCR技术自问世以来,在生物科学领域、分子诊断领域、亲子鉴定、法医鉴定以及犯罪调查等方面发挥了巨大作用,是迄今为止最为重要的技术之一。经过演化和革新,PCR技术已经发展了三代:普通PCR、实时荧光定量PCR(qPCR)以及数字PCR(dPCR)。
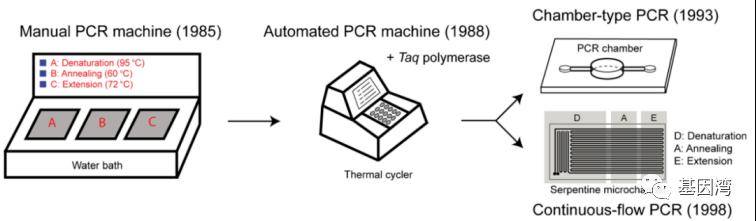
图1 PCR仪器的发展历程
二、PCR的原理及步骤
PCR的基本原理与DNA在体内复制相似,特异性主要依赖于与靶序列两端互补的寡核苷酸引物。PCR由变性、退火和延伸三个基本反应步骤构成:
①模板DNA的变性:DNA模板经过高温(95℃左右)加热一段时间后,解离成单链,以便能够与引物结合;
②DNA模板与引物的退火(复性):将温度降至55℃左右时,引物与模板DNA单链按碱基互补配对的原则互相结合;
③引物的延伸:再将温度调至72℃左右(DNA聚合酶最适反应温度),DNA模板和引物结合物在Taq DNA聚合酶的作用下,按碱基配对与半保留复制原理,沿着5'→3'的方向合成一条新的与模板DNA链互补的半保留复制链。经过变性、退火和延伸重复若干个循环后,就能将待扩目的基因扩增放大几百万倍。
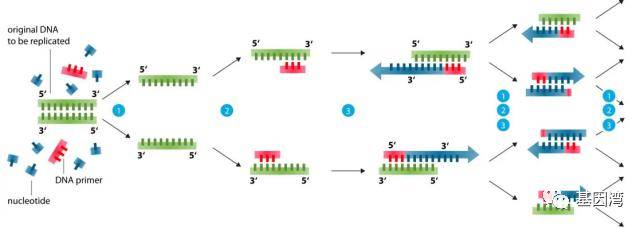
图2 PCR的基本原理
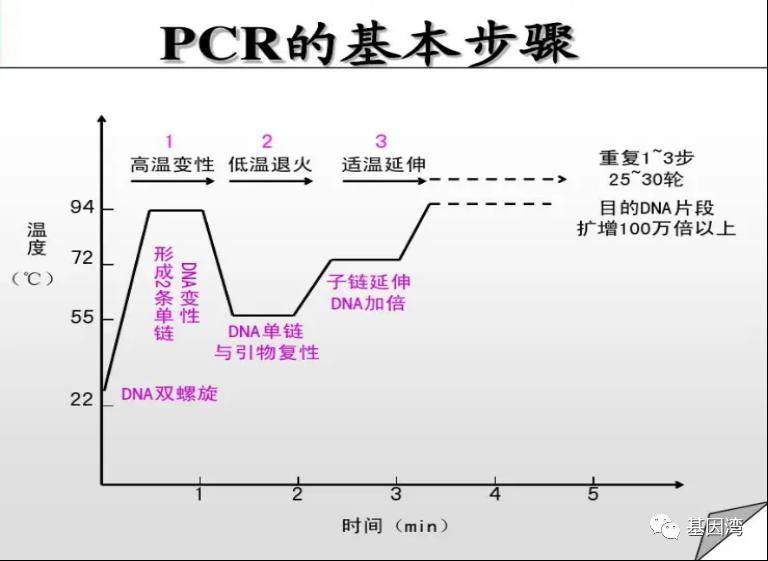
图3 PCR的流程步骤
三、PCR的分类
1.普通 PCR
普通PCR即第一代PCR,普通PCR扩增仪即可扩增靶基因,并通过琼脂糖凝胶电泳对产物进行定性分析。
2.实时荧光定量PCR(Quantitative Real-time PCR, qPCR)
实时荧光定量PCR,即Real-Time PCR,即第二代PCR,是指在PCR扩增反应体系中加入荧光染料或者荧光基团,在整个PCR反应过程中通过收集荧光信号来实时监测每一个循环中扩增产物量的变化,最后通过CT值和标准曲线对待测检测样品进行定量分析。qPCR在聚合酶链反应“变性一退火一延伸”扩增过程的“延伸”段,对荧光探针标记的靶基因荧光信号进行实时采集,通过3个参数(荧光信号-Ct值-靶基因的起始浓度)间的关系,最终确定靶基因的拷贝数或基因的表达水平。
实时荧光定量PCR 极大地扩展了PCR 技术在整个生命科学的研究与应用,例如,感染性疾病、肿瘤遗传性疾病、移植配型、个性化用药等众多医学领域。尤其是在临床医学检验和食品安全检测等领域迅速发展,成为许多病原微生物诊断的金标准。但由于定量 PCR 的绝对定量分析结果最终依赖于 Ct 值和标准曲线,这是其最大的技术瓶颈,所以在某种意义上所谓的“定量”也只是相对的。而且在低拷贝靶基因分子模板浓度差异细微的条件下其检测灵敏度、精确度和分辨率都受到了限制。
qPCR常用的荧光主要有两种:TaqMan探针法和SYBR Green法。
①荧光探针法(TaqMan技术):
TaqMan探针是最早用于定量的方法,也是临床检测中最常用的检测方法。Taqman探针是最为常用的一种水解探针,在探针的5’端存在一个荧光基团,通常为FAM,探针本身则为一段与目的基因互补的序列,在探针的3’端有一个荧光猝灭基团,根据荧光共振能量转移原理(Förster resonance energy transfer, FRET),当报告荧光基团(供体荧光分子)和猝灭荧光基团(受体荧光分子)激发光谱重叠且距离很近时(7-10nm),供体分子的激发可以诱发受体分子发荧光,而自身荧光减弱。所以PCR反应开始,探针游离于体系中完整存在时,报告荧光基团并不会发出荧光,当退火时,引物和探针结合于模板,在延伸阶段,聚合酶不断的合成新链,由于DNA聚合酶具有5’-3’核酸外切酶活性,到达探针时,DNA聚合酶就会将探针从模板上水解下来,报告荧光基团和猝灭荧光基团分开,释放荧光信号。由于探针和模板存在一对一的关系,所以在试验的精度和灵敏度上,探针法都要优于染料法。每扩增一条DNA,就形成一个荧光分子,PCR产物的形成与荧光分子的形成完全同步,PCR产物越多,荧光信号累积的越多,荧光强度越大。
优点:检测特异性强;灵敏度高;适合进行多重qPCR检测;PCR后续无需处理,节省时间和原料成本。
缺点:需要根据不同的序列,合成不同的探针;探针的水解依赖Taq酶外切酶的活性,定量时容易受试剂和酶性能影响;淬灭难以彻底,本底较高;检测结果很难判断实际的扩增特性。
②荧光染料法(SYBR Green):SYBR Green Ⅰ是荧光定量PCR中最常用的荧光染料,它能够与所有的双链DNA结合。在PCR反应体系中,加入SYBR Green Ⅰ,它就会在过程中与双链DNA结合,从而产生荧光信号。因此,反应中发出的全部荧光信号就会与反应中双链DNA的量呈正比,荧光强度也会随着产物的增加而增加。但是由于染料与双链DNA是非特异性结合,因此可能产生假阳性的结果。
优点:价格相对较低;使用方便;对DNA模板没有选择,通用性好;检测灵敏度高。
缺点:可能产生假阳性结果,需要通过熔解曲线分析识别扩增产物的特异性;需要不断优化反应体系以降低非特异性扩增;不适合进行多重qPCR检测。

图4 荧光探针法和荧光染料法的工作原理
注:多重PCR,也称多重引物PCR或复合PCR,是在一个反应体系中加入两对以上引物,同时扩增出多个核酸片段的一种新型PCR扩增技术。
3.数字PCR(Digital PCR, Dig-PCR, dPCR)
数字PCR即第三代PCR,即绝对定量PCR。与传统技术不同,基于泊松分布原理,数字 PCR 技术将 DNA 或RNA 样品分散成大量的微反应单元(纳升级)中,然后对众多微反应单元内的靶序列进行单分子模板 PCR 扩增、荧光检测和统计学分析,实现绝对定量,不依赖于标准曲线和已知浓度的多个梯度标准品,直接检测样品中核酸的原始浓度。由于这种检测方式具有比传统荧光定量 PCR 更加出色的灵敏度和精确性,数字 PCR 迅速得到广泛的关注,尤其在痕量核酸样本检测、复杂背景下稀有突变检测、核酸拷贝数变异和基因表达量微小差异鉴定方面表现出的优势已被普遍认可。
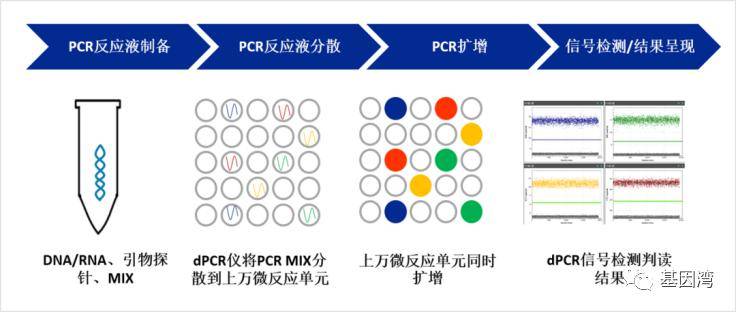
图5 数字PCR的基本原理
4. 逆转录PCR( Reverse T ranion - PCR , RT - PCR)
逆转录PCR或者称反转录PCR(reverse tranion-PCR, RT-PCR),是聚合酶链式反应(PCR)的一种广泛应用的变形。在RT-PCR中,一条RNA链被逆转录成为互补DNA,再以此为模板通过PCR进行DNA扩增。由一条RNA单链转录为互补DNA(cDNA)称作“逆转录”,由依赖RNA的DNA聚合酶(逆转录酶)来完成。随后,DNA的另一条链通过脱氧核苷酸引物和依赖DNA的DNA聚合酶完成,随每个循环倍增,即通常的PCR。作为模板的RNA可以是总RNA、mRNA或体外转录的RNA产物。无论使用何种RNA,关键是确保RNA中无RNA酶和基因组DNA的污染。RT-PCR技术灵敏且应用广泛,可用于检测细胞中基因表达水平,细胞中RNA病毒的含量和直接克隆特定基因的cDNA序列。一般通过一步法或两步法进行,一步法是RT反应和PCR反应在同一试管中进行;而在两步法中两个反应是分开依次进行的。
5.实时荧光定量逆转录PCR(Real-time RT-PCR, RT-qPCR)
Real-time RT-PCR是qPCR和RT-PCR的组合,其中的“RT”是Reverse tranion(逆转录)的意思,所以RT-qPCR是结合了荧光定量技术的逆转录PCR,即以mRNA或总RNA为模板,先反转录得到cDNA,再以cDNA为模板,通过荧光定量PCR进行定量检测分析。因为RT-PCR只可以定性,但不能进行定量分析。与RT-PCR一样,RT-qPCR定量分析RNA也有两种方法:一步法和两步法。两种方法都需要先将RNA反转录为cDNA,然后再将其作为qPCR扩增的模板,只是一步法中的RT和qPCR在同一试管中进行,两步法中的RT和qPCR是按顺序分开进行。
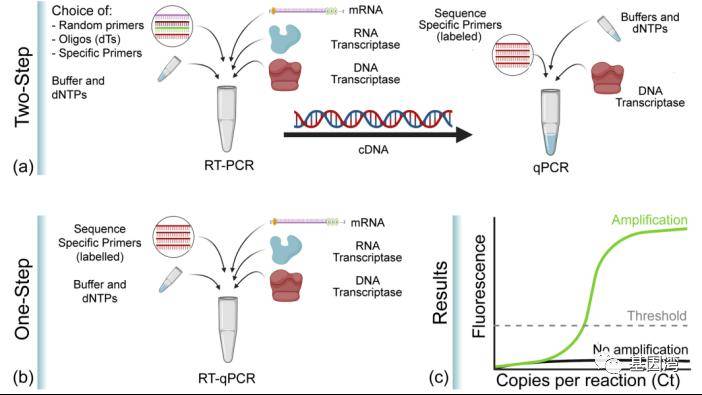
图6 RT-qPCR的一步法和两步法
四、结语
1.PCR,通常指的是普通PCR(一代),以双链DNA为模板,以dNTP为底物进行扩增,进行定性扩增双链DNA。
2.qPCR(Real-time PCR),指的是实时荧光定量PCR,以DNA为模板,以dNTP为底物,对扩增出的DNA进行定量分析。
3.dPCR(数字PCR),以DNA为模板,进行PCR扩增,不依赖于ct值和标准曲线,实现PCR的绝对定量。
3.RT-PCR,指的是逆转录PCR,由mRNA逆转录成的cDNA为模板,以dNTP为底物,进行DNA的扩增,属于PCR的变种,结果只能定性,不能定量。
4.RT-qPCR,指的是实时荧光定量逆转录PCR,是qPCR+RT-PCR的组合,将总RNA或mRNA逆转录成cDNA后再作为模板,以dNTP为底物,进行qPCR的定量分析。