抗原检测市场,产能正在快速爬坡!
新冠检测三种手段-核酸、抗原、抗体
目前,新冠的检测方法主要分为两种:一种是分子层面的核酸检测;一种是免疫学层面的抗原、抗体检测。
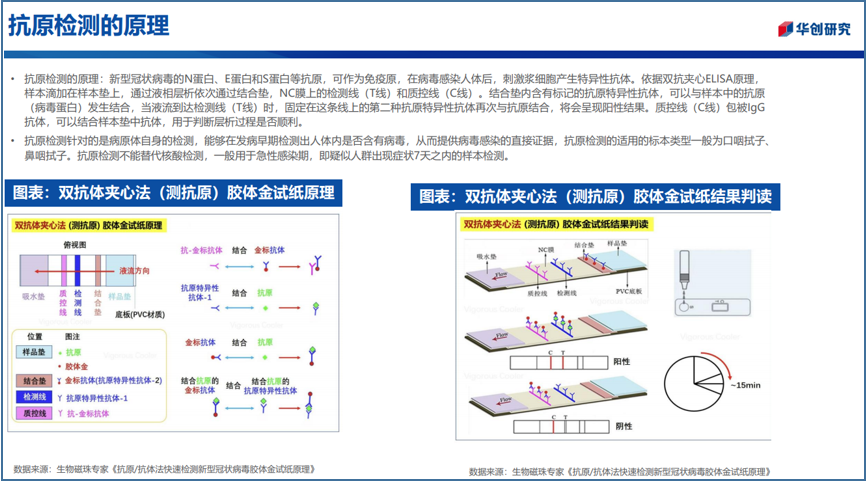
据病毒学家常荣山介绍,从原理上看,抗原检测是直接检测人体样本中病毒颗粒表面的蛋白抗原,核酸检测则是直接检测人体样本中的病毒,但需要破细胞(呼吸道上皮细胞),然后还要提取病毒核酸,逆转录,再做基因扩增,从这个角度看,抗原检测更为直接;而另一种抗体检测则不是检测新冠病毒本身,而是间接检测人体血液里面有无对新冠病毒产生的抗体,继而判定感染情况。
除了检测对象不同外,抗原检测与核酸检测主要的差异在于感染时间。如下曲线图所示,横轴表示与病毒接触的时间,纵轴表示病毒载量,曲线表示在不同时期内的病毒载量变化情况。观图可知,病毒载量较高的时间为感染后的3-7天。其中,快速检测(Detectable by rapid,例如抗原检测)可检测出阳性结果的时间为感染后3-7天;PCR检测(Detectable by PCR,例如核酸检测)可检测出阳性结果的时间为2-14天。因此,在新冠病毒感染2-3天以后,如果用现有的抗原检测产品做检测,其灵敏度已经和核酸检测的差距不大。一方面,此时核酸的病毒载量比较高,病毒水平远在抗原检测和核酸检测的检出水平之上,两种检测方式都能检出。另一方面,若使用者实在担心漏检,由于抗原检测方便又快速,居家可进行,可以连续检测2天,基本上都能检出。
由此常荣山认为,在欧美国家新冠病毒感染率整体超过1%的情况下,抗原检测和核酸检测在检测阳性方面能力差异不大。与核酸检测相比,抗原检测最显著优势是快。其检测时间约15分钟,是核酸检测的十分之一。并且,它不依赖设备、实验室和人力运输,仅需要测试试纸。无论是消费者所消耗的时间精力,还是检测成本,亦或是检测体验,抗原检测都拥有核酸检测不具备的优势。
抗原检测在全球的应用情况
在国外疫情的防控实践中,新冠抗原居家自检适用于大范围普筛自查,是对核酸检测的有效补充。美国、欧盟、澳大利亚等地对于抗原自检使用规则均明确指出可以补充但不可替代核酸检测方法。
目前在中国香港地区的抗疫实践中,抗原检测也正在起到不可忽视的作用。
今年香港疫情,为达到早发现、早隔离、早治疗的目标,香港政府正采购大量快速抗原测试包,供不同群组人士进行检测,以尽早识别出患者及截断病毒传播链。
快速抗原测试需结合临床诊断和其他实验室测试的结果,以完成对疑似感染者样本中的抗原拟作定性检测。
香港市民可向市面零售商购买快速抗原测试包作自愿测试,同时,政府向指定高风险及特定群组及居安抗疫人士免费提供快速抗原测试包。
香港政府向指定群组免费发放的抗原试剂盒品牌包括亚辉龙、热景生物、万孚生物、雅培等国内外企业共9家。
新冠抗原检测市场分析
连日以来,全国多地优化完善疫情防控的措施。随着疫情防控政策的逐步优化,抗原检测有望成为重要检测手段,包括成都、广州、北京、重庆等多地宣布不再按行政区域开展全员核酸检测,并鼓励家庭自备抗原试剂盒。阶段性需求爆发或将带动抗原产品的放量,生产厂商及相关渠道有望在这一过程中发挥重要作用。
在此之前(11月21日),国家层面发布的最新版《新冠肺炎疫情防控核酸检测实施办法》明确表示,没有发生疫情的地区,一般不按行政区域开展全员核酸检测,对曾发现阳性感染者的楼宇、院落可先行抗原检测,阴性后再有序进行核酸检测。
此外,政府、企事业单位、医疗终端、港口、机场、海运、外卖员、出租车司机等场景,家庭自备抗原试剂也还有巨大的释放空间。
尤其在院外自测初期,在渠道备货和居家囤货需求下,需求可能集中释放,弹性较大;中长期引流战略价值显著,值得注意的是,抗原检测试剂除了提供业绩增量,可能是产业链的上中下游具有引流价值,尤其是药店渠道,头部药店有望对接 IVD 厂家,吸引和绑定客流,加速行业整合。
基于抗原市场短期需要满足国际、国内市场同步供应,短期需求暴增导致产能跟不上。后期随着产能快速扩大,价格将会持续下滑,市场也将回归常态化。
最终,抗原市场的容量到底有多大,小编分析主要来自于大众看待新冠的观念以及官方对新冠病毒的最终定义。
对于抗原产品的市场前景,中泰证券分析认为,如果国内抗原自检试剂盒正式放开,预计国内新冠抗原自检试剂盒市场单月规模有望达到280亿元,再结合中国居民、企业有储备习惯的情况,新冠抗原检测产品采购需求单月或达560亿元,年需求将达到6000亿元。
从目前国内获批的36种新冠病毒抗原检测试剂产品分类来看,胶体金法布局企业较多,包括广州万孚生物、南京诺唯赞、北京热景生物、北京万泰生物、武汉明德生物、浙江东方基因、上海伯杰医疗、复星诊断、之江生物等;乳胶法布局企业包括北京金沃夫、杭州奥泰生物、艾康生物、英诺特,珠海丽珠试剂、精硕生物、海孵医疗、无锡科智达等;荧光免疫层析法布局企业涉及深圳华大因源、北京华科泰、深圳易瑞生物;磁微粒化学发光法布局企业包括厦门万泰凯瑞生物,于12月2日获得国家药品监督管理局批准上市。
国家监管部门对于三类医疗器械证的批准,是需要至少2到3年的时间的。研发到商业化也有一段较长的路,这对于创业型公司而言,会错过检测试剂盒的最快成长阶段。